L'immunité innée, l'épigénétique et le métabolisme
Le sepsis survient lorsque la réponse immunitaire de notre corps contre l’infection devient préjudiciable à celui-ci. Avec plus de 25 millions de cas dont 8 millions mortels par année au niveau mondial, le sepsis est l’une des affections les plus courantes bien que des moins reconnues. En mai 2017, l'Assemblée mondiale de la Santé et l'Organisation mondiale de la Santé (OMS) ont fait du sepsis une priorité mondiale en adoptant une résolution pour améliorer la prévention, le diagnostique et la gestion du sepsis. S’inscrivant dans ce contexte, le but de nos travaux est d’approfondir nos connaissances des mécanismes régulant la réponse immunitaire anti-infectieuse, ceci afin de développer de nouveaux outils de diagnostique et de traitement du sepsis.
Principal sujet de recherche
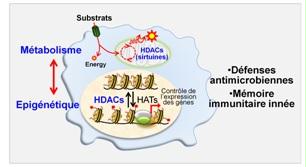
Métabolisme, épigénétique et défenses anti-infectieuses: le rôle des déacétylases d'histones
Pour prévenir et combattre les infections, notre corps dispose d’un système de défense très performant, le système immunitaire inné. Lors de la reconnaissance d’un microorganisme pathogène, les cellules du système immunitaire inné adaptent leur métabolisme pour répondre aux besoins énergétiques nécessaires à assurer leur fonction de défense. Cette adaptation métabolique est associée à des modifications épigénétiques qui affectent la structure et l’entourage des gènes sans en changer la séquence. Une découverte récente en immunologie, remettant en question le dogme selon lequel la mémoire immunitaire est une spécificité du système immunitaire adaptatif, a été la mise en évidence que des modifications métaboliques et épigénétiques sont associées à l'acquisition d’une forme de mémoire par les cellules de l’immunité innée. Par ailleurs, des dérèglements épigénétiques et des métaboliques sont observés chez les patients souffrant de sepsis.
Les enzymes de la famille des déacetylases d’histones (HDACs) participent au contrôle du métabolique et de l’épigénétique. Nous étudions l’impact de drogues ou de produits naturels (produits dans nos intestins) ciblant les HDACs ainsi que celui de la déficience en certaines HDACs (notamment des sirtuines) sur la réponse inflammatoire et anti-infectieuse ainsi que sur la survenue du sepsis. Nous testons également dans quelle mesure les HDACs participent à l’établissement de la mémoire par les cellules de l’immunité innée.
- Roger et al., Blood. 2011;117(4):1205
- Mombelli et al., J Infect Dis. 2011;204(9):1367
- Ciarlo et al., Int J Antimicrob Agents. 2013;42 Suppl:S8
- Ciarlo et al., Sci Rep. 2016;6:37944
- Ciarlo et al., Sci Rep. 2017;7(1):3853.
- Ciarlo et al.,Front Immunol. 2017;8:1037
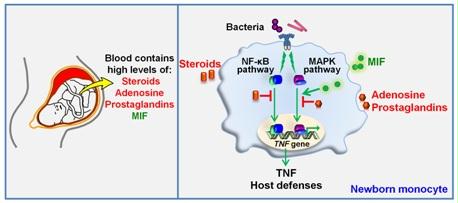
Immunité innée néonatale
Près de 3 millions de nouveau-nés meurent chaque année. Les infections représentent la seconde cause de mortalité néonatale (i.e. pendant les 4 premières semaines de vie). Cette susceptibilité exacerbée des nouveau-nés aux infections est associée à leur capacité limitée à développer une réponse immunitaire innée efficace. En collaboration avec le Dr Giannoni du Service de Néonatologie du CHUV, nous étudions les mécanismes sous-jacents la sensibilité aux infections des nouveau-nés.
Le sang des fœtus et nouveau-nés contient des concentrations très élevées en médiateurs anti-inflammatoires que sont les hormones stéroïdiennes, l’adénosine et les prostaglandines (gauche). Nous avons démontré que les stéroïdes dérivés du placenta, en inhibant la voie NF-κB, sont de puissants immunosuppresseurs de la réponse immunitaire innée des monocytes de nouveau-nés (droite). Par ailleurs, nous avons mis en évidence que la cytokine pro-inflammatoire MIF (pour macrophage migration inhibitory factor) est présente à des concentrations 10 fois plus élevées dans le sang de nouveau-nés par rapport à celui d’adultes. Ces niveaux élevés de MIF contrebalancent l'activité immunosuppressive de l'adénosine et des prostaglandines au niveau de la voie des MAPKs. Ces données remettent en question le concept selon lequel le système immunitaire néonatal est purement immature et suggèrent l'existence de mécanismes compensant en partie l'immunosuppression néonatale.
- Giannoni et al., Infect Immun. 2011;79(7):2690
- Schlapbach et al., Intensive Care Med. 2013;39(4):754
- Roger et al., Proc Natl Acad Sci U S A. 2016;113(8):E997
- Giannoni et al., Méd Sci (Paris). 2016;32(12):1062
- Roger et al. Front Immunol. 2017;8:26
Identification de biomarqueurs et de cible thérapeutiques du sepsis
Le sepsis est un syndrome clinique caractérisé par une réponse inappropriée de l’hôte envers une infection, qui engendre une dysfonction d’organe (définition Sepsis-3 publiée dans la revue JAMA en 2016). La grande hétérogénéité des patients atteints de sepsis est certainement la principale raison pour laquelle de nombreux essais cliniques n'ont pas montré d’effet bénéfique des stratégies immunomodulatrices. En effet, suivant les prédispositions individuelles et la phase du sepsis, on peut envisager de cibler la réponse inflammatoire ou l'immunoparalysie, voir le métabolisme au bénéfice du patient. Le sepsis est donc une condition pour laquelle la médecine personnalisée pourrait être appliquée. Au travers notamment de collaborations internationales (Horizon 2020 Marie-Skłodowska-Curie Innovative Training Network), nous visons à développer et valider des biomarqueurs génétiques, moléculaires et cellulaires permettant la mise en œuvre de stratégies personnalisées du sepsis.
- Roger et al., Proc Natl Acad Sci U S A. 2009;106(7):2348
- Kerschbaumer et al., J Biol Chem. 2012;287(10):7446
- Renner et al., FASEB J. 2012;26(2):907
- Savva & Roger, Front Immunol. 2013;4:387
- Herderschee et al., J Leukoc Biol. 2015;98(1):23
- Stalder et al., PLoS One. 2016;11(10):e0163542
- Savva et al., Proc Natl Acad Sci U S A. 2016;113(13):3597
- Also see : http://europeansepsisacademy.com/
Contacts
CLE
Building D, Level 4
Chemin des Boveresses 155
CH-1066 Epalinges-Lausanne, Suisse



